A espectroscopia, de modo geral, estuda a interação da radiação com a matéria por meio de espectros de transições atômicas ou moleculares. As transições atômicas, podem ser observadas quando o composto está na fase gasosa. Por outro lado, transições moleculares são observadas tanto em gases como em líquidos e sólidos. Análises espectroscópicas foram fundamentais no desenvolvimento da teoria quântica, na determinação de isótopos, identificação de elementos químicos, etc.
Características da Espectroscopia atômica:
A espectroscopia atômica, ocorre em átomos livres na fase gasosa, e suas transições (emissão ou absorção) ocorrem em níveis eletrônicos, com energias na faixa do UV-vis. Assim, átomos gasosos no estado fundamental ao absorver energia radiante em comprimentos de onda específicos (UV-vis), são capazes de promover a excitação de elétrons da camada de valência para níveis mais elevados energeticamente e em seguida emitem energia (conforme Figura 1), dando origem a um espectro de energia (de absorção ou emissão). Tais espectros são constituídos de linhas discretas.

Figura 1: A figura mostra um esquema do processo de absorção de uma certa quantidade de energia. E logo após é observado a emissão de energia (veja a linha discreta amarela no espectro de emissão e as respectivas linhas pretas no espectro de absorção).
A Figura 1 mostra o processo de popular os estados de maior energia, ou seja, fazer o átomo absorver energia, elevando sua população de elétrons para um orbital de maior energia. Após esse processo, tais elétrons se encontram em um estado (”posição”) não estável (”desconfortável”) e tendem a retornar para o seu estado fundamental (de menor energia) para manter sua estabilidade. Isso faz com que os elétrons percam energia (durante essa mudança de orbital). A energia perdida é emitida na forma de luz (fótons). E o valor dessa energia (E) é a diferença de energia entre os dois níveis em questão: E = Ef – Ei. Lembrando que para que ocorra essa transição eletrônica a energia incidente deve ser no mínimo da ordem do UV-vis, caso contrário os elétrons não serão promovidos para um nível superior.
Teste da chama:
Em espectroscopia atômica a substância que está sendo analisada precisa antes ser decomposta em átomos por meio de uma chama, um forno ou um plasma (ou seja, substâncias liquidas e sólidas precisam ser atomizadas). Abaixo, você pode observar o teste da chama, na qual você coloca um material (líquidos ou pós) em uma chama e parte desse material é atomizado. Quando esses átomos absorvem uma quantidade específica de energia de uma chama eles emitem luz no comprimento de onda específico ao qual absorveram. Desta forma, para diferentes materiais ou elementos químicos (como por exemplo, sais compostos por metais: NaCl, CuCl2, etc.) você pode observar a emissão de energia em diferentes cores conforme for o valor de energia absorvido (ou seja, conforme for o comprimento de onda/freqüência da energia absorvida). Podemos observar, pois a energia absorvida/emitida é na faixa do visível, caso contrário, não poderíamos observar. (OBS: Em espectros moleculares, na qual ocorrem transições rotacionais – faixa do micro-ondas e vibracionais – faixa do infra-vermelho não observamos a luz emitida).
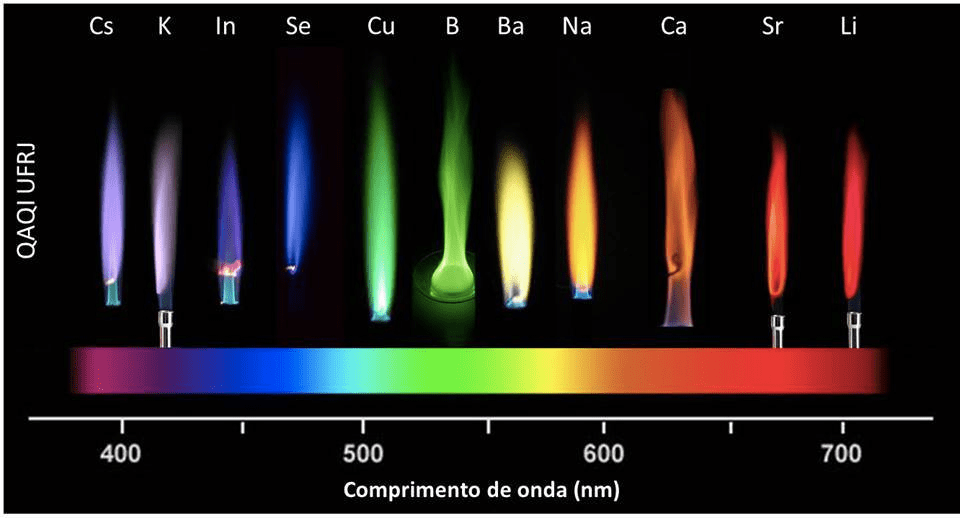

Figura 2: Teste da chama para diferentes elementos químicos (imagem superior). As cores da explosão dos fogos (imagem inferior) são resultado do contato do fogo com algum elemento químico específico incorporado aos fogos. Estes elementos, absorvem e emitem energia em uma faixa específica de comprimento de onda ou frequência, que é visível ao olho humano.
Aplicações da espectroscopia atômica:
- Análises clínicas: análise de amostras de sangue ou urina.
- Análises forenses: Pb (projéteis de armas de fogo), elementos tóxicos (envenenamentos).
- Amostras ambientais: águas, solos, rochas, sedimentos, ar atmosféricos (chaminés).
- Materiais metalúrgicos: ligas metálicas (pureza ou presença de contaminantes).
- Análise de aditivos em alimentos, medicamentos, cosméticos.
Fontes: Robert Eisberg, Física Quântica – Átomos, Moléculas, Sólidos, Núcleos e Partículas, 1º edição (1979). Disponível em < http://www.iq.usp.br/hvlinner/Absorcao%20e%20emissao%20atomica.pdf> , < https://www.facebook.com/QualitativaInorgUfrj> acesso em 2023.
Deixe um comentário